¿Qué es cobimetinib?
Cobimetinib (Cotellic ™, Genentech Inc. California, EE. UU.) Es un medicamento recetado que se usa, en combinación con vemurafenib, para el tratamiento de pacientes con melanoma.
Cobimetinib recibió la aprobación de la Administración de Drogas y Alimentos de los EE. UU. (FDA) en los EE. UU. En 2015. En abril de 2017, Medsafe aprobó el cobimetinib para el tratamiento de pacientes con melanoma en Nueva Zelanda.
Melanoma metastásico
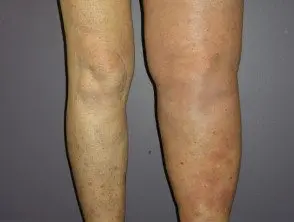
Melanoma metastásico
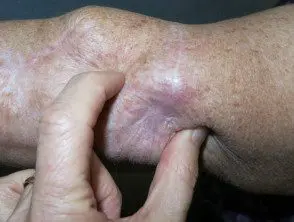
Melanoma metastásico
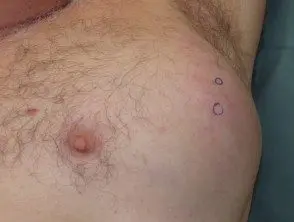
Melanoma metastásico
¿Quién debe tomar cobimetinib?
Cobimetinib, en combinación con vemurafenib, está indicado para el tratamiento de pacientes con enfermedad no resecable o metastásico melanoma, en el que el cáncer que se ha extendido a otras partes del cuerpo o que no se puede extirpar mediante cirugía. Un indicador de este melanoma es un trastorno anormal. gene llamó al BRAF V600E o V600K mutación, que debe confirmarse en tumor muestras antes del inicio del tratamiento.
Cobimetinib no está indicado para el tratamiento de pacientes con un tipo normal o salvaje BRAF gene.
¿Cómo funciona cobimetinib?
Cobimetinib es un pequeño molécula inhibidor que bloquea el MEK enzima, un componente de la cascada de quinasa en la vía de la proteína quinasa activada por mitógeno (MAPK). Los componentes de las vías MAPK con frecuencia mutan en pacientes con maligno melanoma, particularmente el RAF isoforma BRAF. Mutaciones de BRAF causar una activación constitutiva de estas vías de señalización, lo que puede provocar cáncer.
Cobimetinib y vemurafenib se dirigen a dos quinasas diferentes en la vía MAPK. Los ensayos clínicos han demostrado que la combinación de cobimetinib con vemurafenib da como resultado mejoras en la supervivencia en pacientes con melanoma que albergan BRAF Mutación V600.
¿Cómo se administra cobimetinib?
Dosis recomendada
Cobimetinib está disponible en tabletas de 20 mg bajo la marca Cotellic.
- La dosis recomendada es de 60 mg una vez al día durante los primeros 21 días de cada ciclo de 28 días, continuada hasta la progresión de la enfermedad o intolerable toxicidad ocurre.
- Cobimetinib puede tomarse con o sin alimentos.
- Si se omite una dosis o si se produce el vómito cuando se toma la dosis, reanude la dosificación con la siguiente dosis programada.
Vemurafenib (ZELBORAF ™) debe tomarse cada 12 horas por cada día en el ciclo de 28 días (sin período de descanso). Si se olvida una dosis de vemurafenib, debe tomarse tan pronto como se recuerde. No compense la dosis omitida si la dosis omitida está dentro de las 4 horas de la siguiente dosis programada.
Uso de cobimetinib en poblaciones específicas.
Mujer embarazada
No hay datos disponibles sobre el uso de cobimetinib en mujeres embarazadas para informar sobre un riesgo asociado con el medicamento para defectos congénitos y abortos espontáneos importantes. Según los hallazgos de los estudios de reproducción animal y su mecanismo de acción, cobimetinib puede causar daño fetal. Se debe informar a las mujeres embarazadas sobre el riesgo potencial para el feto.
Las mujeres en período de lactancia
No hay información sobre la presencia de cobimetinib en la leche humana o sus efectos en un lactante amamantado. El potencial riesgo-beneficio debe considerarse al recetar cobimetinib a la madre. Se debe aconsejar a las mujeres lactantes que no amamanten durante el tratamiento con cobimetinib y durante 2 semanas después de la dosis final.
Niños
La seguridad y eficacia de cobimetinib no se han evaluado en niños.
Hembras y machos con potencial reproductivo
Se debe recomendar a las pacientes con potencial reproductivo que utilicen métodos anticonceptivos efectivos durante el tratamiento con cobimetinib y durante 2 semanas después de la dosis final. Según los hallazgos en animales, cobimetinib puede reducir la fertilidad en hembras y machos con potencial reproductivo.
Personas mayores
Los estudios clínicos con cobimetinib no incluyeron un número suficiente de individuos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
Individuos con hepático o renal discapacidad
No se requiere el ajuste de dosis de cobimetinib en pacientes con insuficiencia hepática leve (puntuación A de Child-Pugh A), moderada (Child-Pugh B) o grave (Child-Pugh C). No dedicado farmacocinética Se ha realizado un ensayo en pacientes con insuficiencia renal. El ajuste de la dosis no se recomienda para insuficiencia renal leve a moderada (aclaramiento de creatinina 30-89 ml / minuto) según los resultados del análisis farmacocinético de la población. No se ha establecido una dosis recomendada para pacientes con insuficiencia renal grave.
¿Cuáles son los posibles efectos secundarios del cobimetinib?
Los efectos secundarios comunes incluyen:
- Diarrea
- Erupción
- Fotosensibilidad
- Náusea
- Estomatitis
- Fiebre
- Alopecia
- Trombocitopenia.
Los efectos secundarios poco frecuentes pero potencialmente graves incluyen:
- Diarrea severa que conduce a deshidratación e insuficiencia renal.
- Rabdomiólisis
- Toxicidad cardiaca
- Desprendimiento de retina
- Toxicidad embriofetal
- Dolor en las articulaciones (artralgia)
Hepatotoxicidad
Elevaciones en suero Los niveles de aminotransferasa y fosfatasa alcalina son comunes durante la terapia con vemurafenib, y son aún más comunes cuando se combina con cobimetinib.
Instancias de daño hepático clínicamente aparente con ictericia se han informado durante los ensayos clínicos de terapia con cobimetinib y vemurafenib, pero las características clínicas, el curso y los resultados de estos episodios no se han descrito en detalle.
Los inhibidores de la vía MAPK como clase a menudo se asocian con elevaciones transitorias de la enzima sérica y, más raramente, con casos de daño hepático clínicamente aparente, pero las características clínicas no se han descrito y la asociación con cobimetinib no se ha definido claramente.
La tasa de daño hepático clínicamente significativo y la insuficiencia hepática asociada con los inhibidores de la proteína quinasa aumenta en pacientes con preexistencia cirrosis o insuficiencia hepática debido a la carga tumoral hepática. La etiqueta del producto para cobimetinib recomienda el monitoreo de las pruebas de función hepática de rutina durante el tratamiento.
Las elevaciones séricas de aminotransferasas por encima de cinco veces el límite superior de lo normal (si se confirma) deberían conducir a la interrupción temporal, que debería volverse permanente si estos valores de laboratorio no mejoran significativamente o no se resuelven en unas pocas semanas.
No parece haber reactividad cruzada con otros tirosina quinasa receptor inhibidores En algunas situaciones, puede ser apropiado cambiar a otro inhibidor de la proteína quinasa.
Riesgo de nuevos cánceres.
Cobimetinib en combinación con vemurafenib puede causar nuevos cánceres de piel. Estos pueden incluir:
- Cutáneo escamoso celda carcinoma
-
Queratoacantoma
- Basal carcinoma celular
Problemas del corazón
Miocardiopatía, definido como sintomático y asintomático La disminución de la fracción de eyección ventricular izquierda (FEVI) puede ocurrir con cobimetinib.
La seguridad de cobimetinib no se ha establecido en pacientes con base FEVI que está por debajo del límite inferior institucional normal o por debajo del 50%.
La FEVI debe evaluarse antes del inicio de cobimetinib, 1 mes después del inicio y, posteriormente, cada 3 meses hasta la interrupción del fármaco. Eventos de ventrículo izquierdo disfunción debe manejarse a través de la interrupción, reducción o interrupción del tratamiento.
Interacciones con la drogas
Cobimetinib se metaboliza en el hígado a través del sistema del citocromo P450, predominantemente CYP3A, y es susceptible a las interacciones farmacológicas con inhibidores o inductores potentes de esta enzima microsomal.
La administración conjunta de cobimetinib con itraconazol (un inhibidor potente de CYP3A4) aumentó cobimetinib sistémico exposición por 6,7 veces.
Concurrente Se debe evitar el uso de cobimetinib e inhibidores potentes o moderados del CYP3A. Si el uso simultáneo a corto plazo (14 días o menos) de inhibidores moderados del CYP3A, incluidos ciertos antibióticos (p. Ej., Eritromicina, ciprofloxacina) es inevitable (14 días o menos), la dosis de cobimetinib debe reducirse de 60 a 20 mg.
Se debe utilizar una alternativa a un inhibidor CYP3A fuerte o moderado en pacientes que están tomando una dosis reducida de cobimetinib (40 o 20 mg al día). Después de la interrupción de un inhibidor moderado de CYP3A, cobimetinib debe reanudarse con la dosis previa.
La administración conjunta de cobimetinib con un inductor potente de CYP3A puede disminuir la exposición sistémica de cobimetinib en más del 80% y reducir su eficacia. Se debe evitar el uso simultáneo de cobimetinib e inductores potentes o moderados de CYP3A, que incluyen, entre otros, carbamazepina, efavirenz, fenitoína, rifampicina y hierba de San Juan.
Contraindicaciones
Cobimetinib debe ser retenido en las siguientes circunstancias:
- Una historia de problemas de salud mental, incluyendo pensamientos suicidas, depresión, ansiedad o problemas de humor.
- Concurrente infección que no desaparece o que sigue regresando
-
Tuberculosis (TB) o contacto cercano con alguien con TB
- Recientemente recibido o programado para recibir una vacuna
- Plan para quedar embarazada
-
Amamantamiento o plan de amamantar.

